
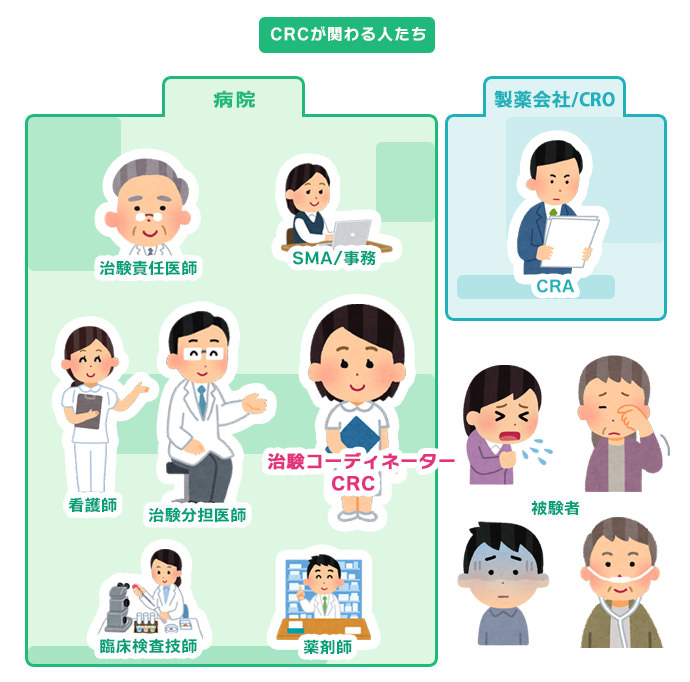
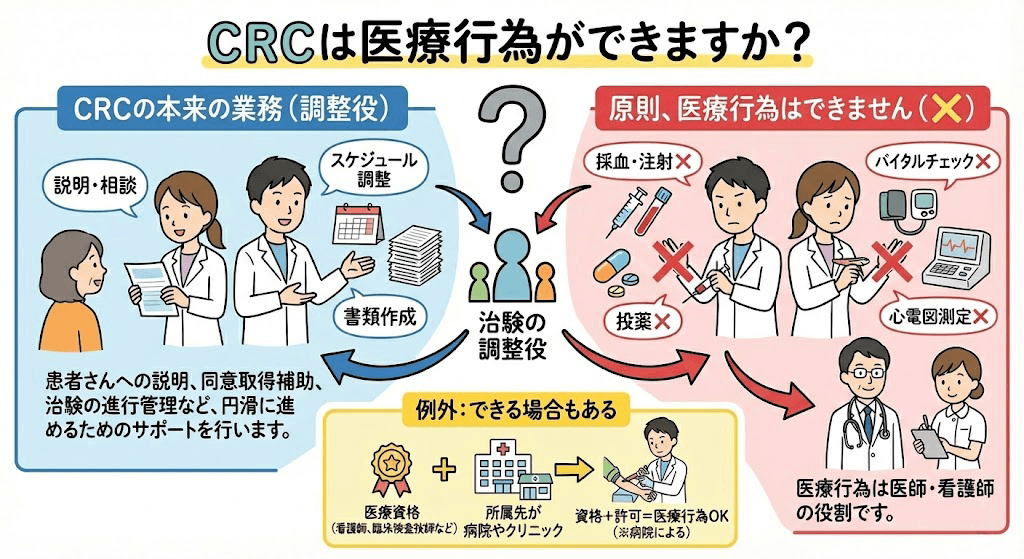
治験コーディネーター(CRC)は、治験を実施する際に遵守すべき基準であるGCPや治験の計画書に従って、治験が適切に行われるように各部署を調整(コーディネート)する仕事です。患者様だけでなく、製薬会社や病院で働いているさまざまな職種の方と協力して業務を行います。
この記事では、現役の治験コーディネーター(CRC)の声や現場の裏話、写真やイラストを交えて、治験コーディネーター(CRC)の仕事内容を分かりやすく解説しています。「治験コーディネーター(CRC)って何をする人?」「治験コーディネーター(CRC)の仕事内容が分からない!」という方は、ぜひご覧ください。



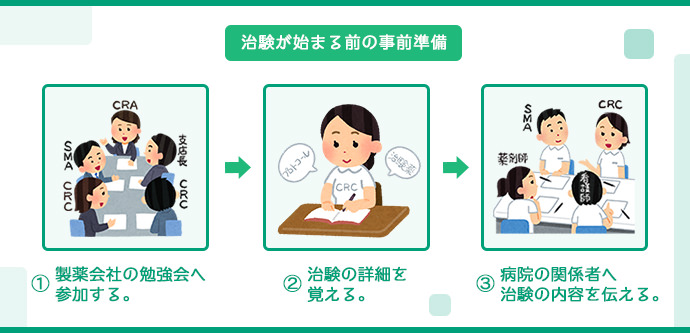
 治験の事前準備
治験の事前準備





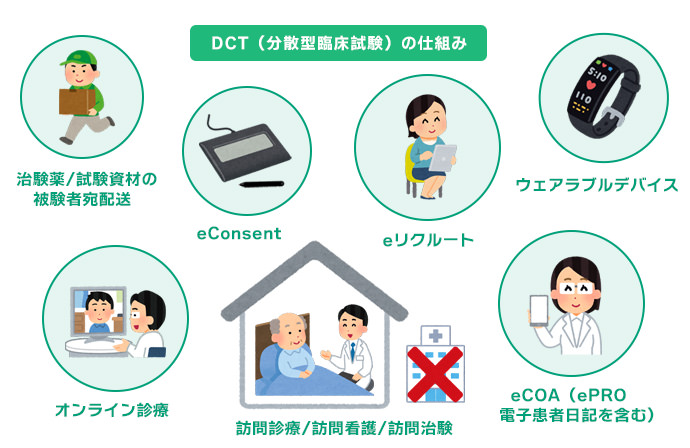
 治験の開始
治験の開始


 選択基準と除外基準
選択基準と除外基準 被験者候補の探し方
被験者候補の探し方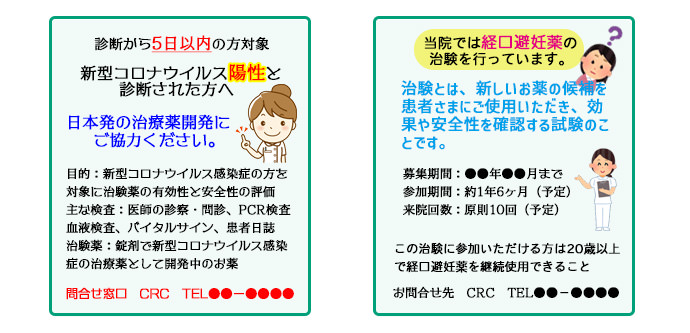





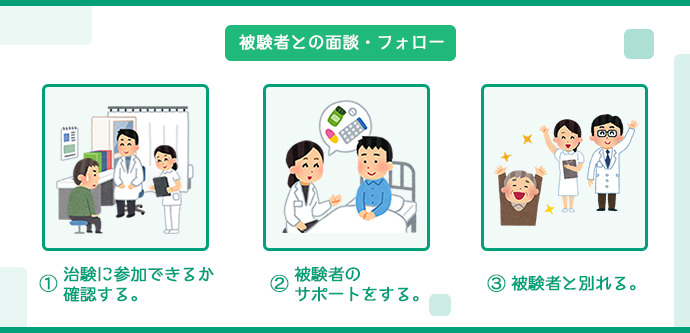
 被験者との面談・フォロー
被験者との面談・フォロー







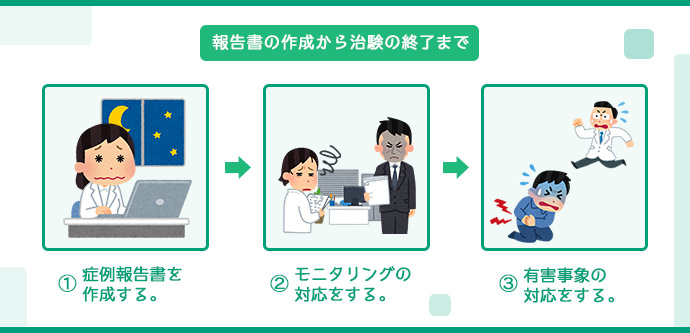
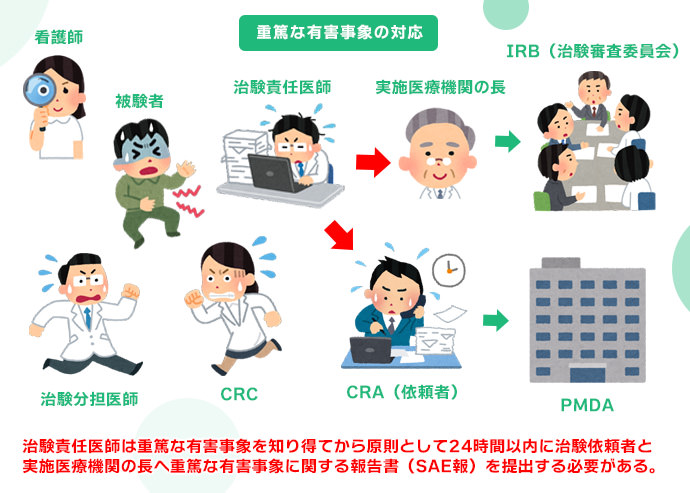
 報告書の作成と治験の終了
報告書の作成と治験の終了









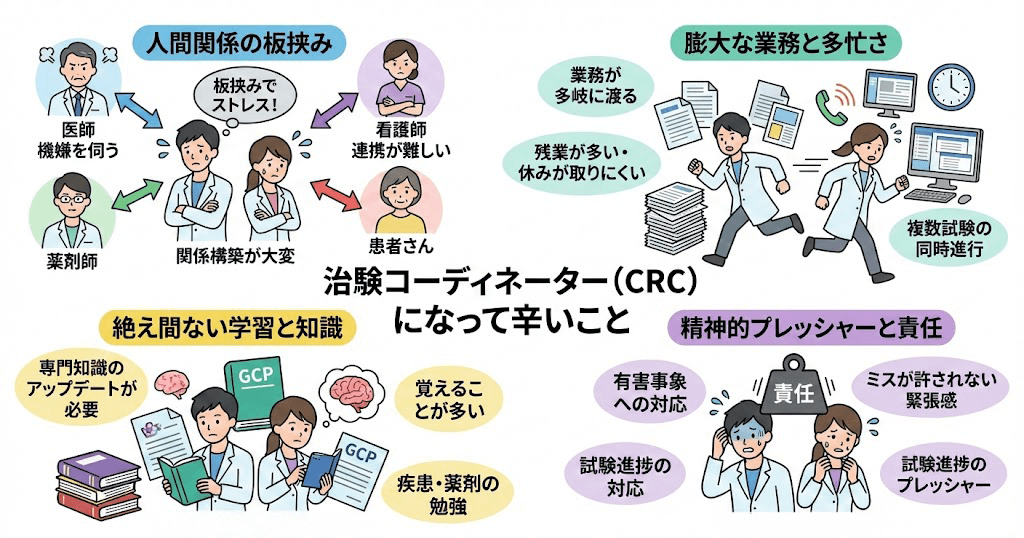
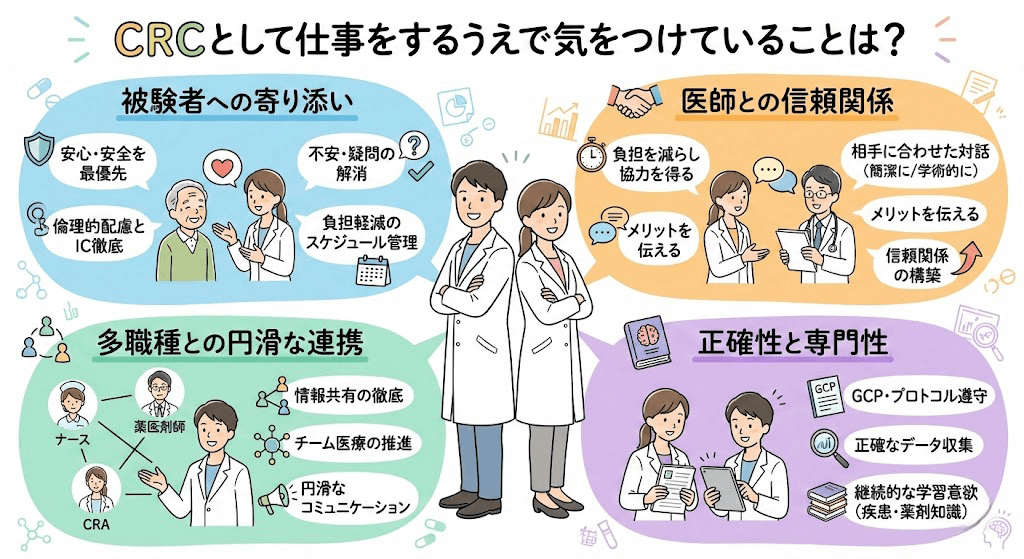
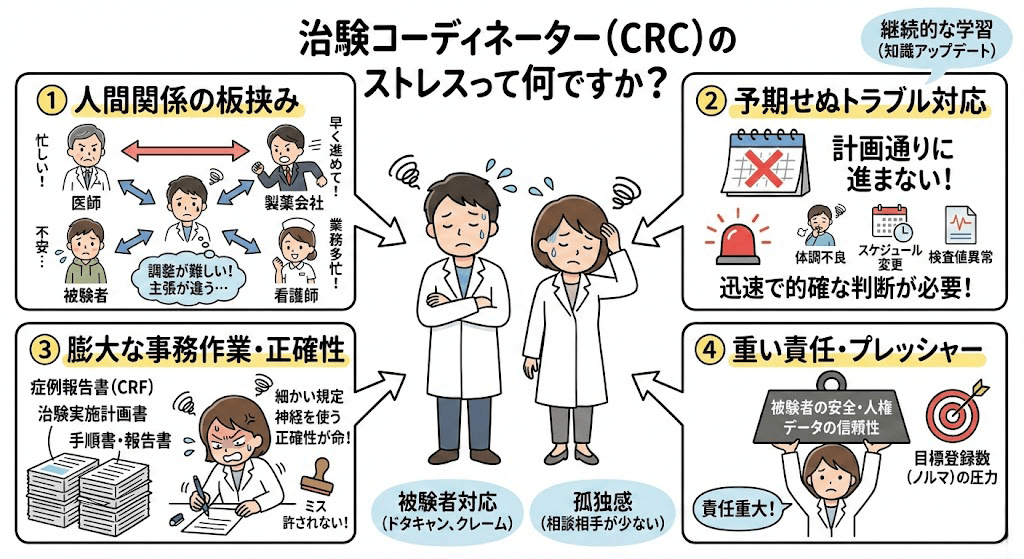
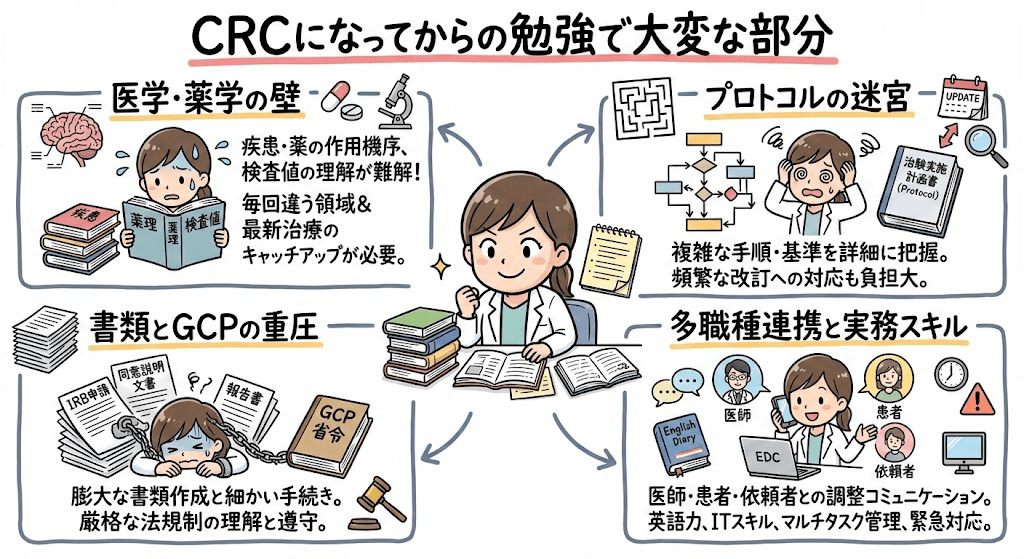
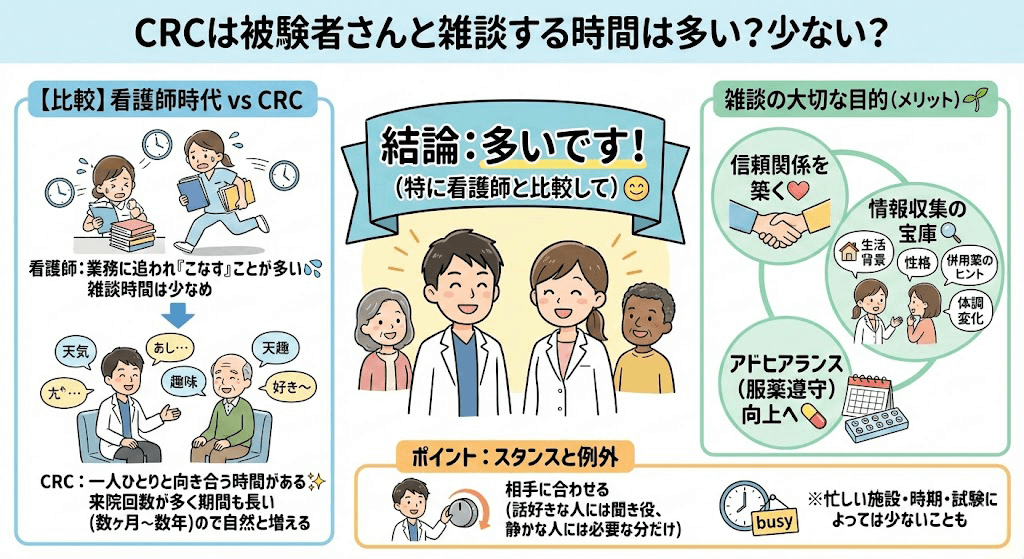
 よくある質問とみんなの回答
よくある質問とみんなの回答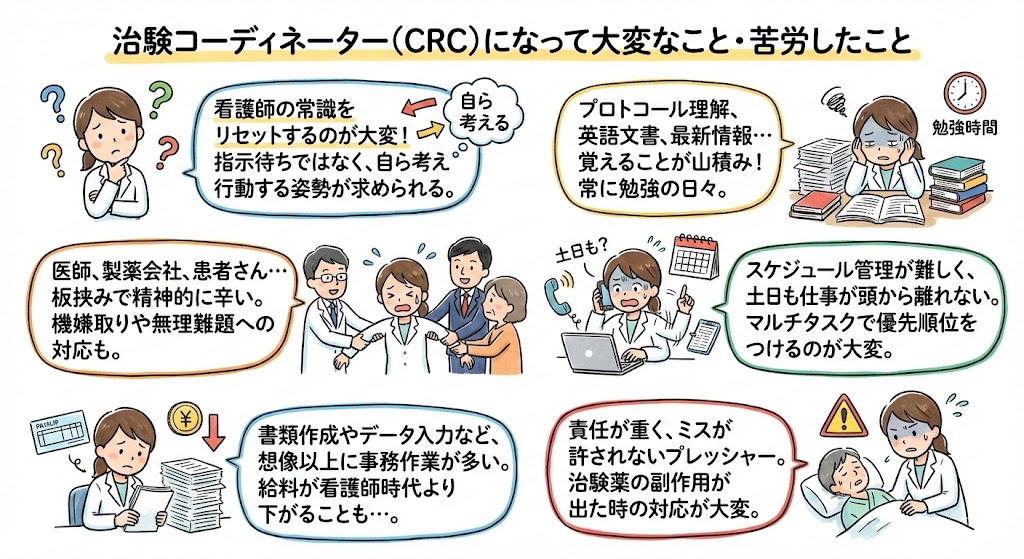




 年収査定はこちら
年収査定はこちら
 合格予想はこちら
合格予想はこちら
 掲示板で質問をする
掲示板で質問をする








 CRC
CRC

 CRCの
CRCの
 CRCの
CRCの
 CRCの
CRCの
 CRCの
CRCの
 CRCに
CRCに
 CRCの
CRCの
 SMO
SMO
 SMO
SMO
 応募先の
応募先の
 治験
治験
 院内CRCと
院内CRCと



 2026年4月からの転職
2026年4月からの転職 CRC未経験特集
CRC未経験特集 CRC経験者特集
CRC経験者特集 看護師特集
看護師特集 臨床検査技師特集
臨床検査技師特集 保健師特集
保健師特集 薬剤師特集
薬剤師特集 管理栄養士特集
管理栄養士特集 臨床工学技士特集
臨床工学技士特集 理学療法士特集
理学療法士特集 作業療法士特集
作業療法士特集 臨床心理士特集
臨床心理士特集 MR特集
MR特集 CRA経験者特集
CRA経験者特集


 求人検索
求人検索  ログイン
ログイン 会員さま専用
会員さま専用 CRCの仕事
CRCの仕事  治験業界の研究
治験業界の研究 経験・資格別の注意点
経験・資格別の注意点 応募書類の作成
応募書類の作成 面接・適性検査の対策
面接・適性検査の対策 みんなのクチコミ
みんなのクチコミ みんなの質問と回答
みんなの質問と回答 転職成功事例
転職成功事例 マンガで分かるCRC
マンガで分かるCRC CRCばんくチャンネル
CRCばんくチャンネル 便利な機能
便利な機能 相談/年収査定/合格予想
相談/年収査定/合格予想 2026年から働くには?
2026年から働くには? 退職手続き
退職手続き 開催中のキャンペーン
開催中のキャンペーン 《CRCばんく》とは
《CRCばんく》とは