
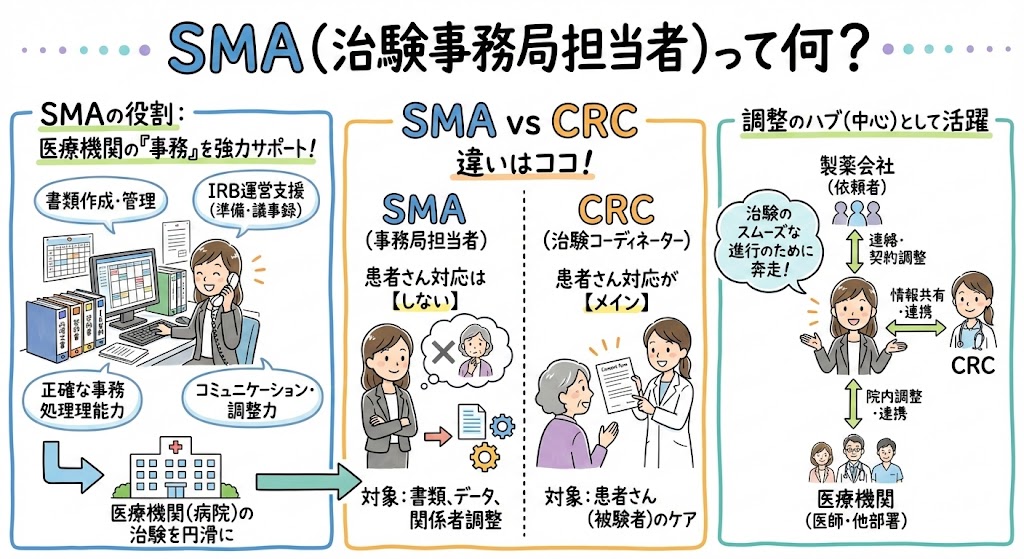
SMAとはSite Management Associateの略で、治験事務局担当者とも呼ばれます。SMA(治験事務局担当者)の主な業務は、CRC(治験コーディネーター)やCRA(臨床開発モニター)、治験担当医師が治験をスムーズに行えるように、治験に必要な書類の作成や管理、各種委員会の運営サポートをすることです。SMA(治験事務局担当者)は治験に必要な書類を作成するプロフェッショナルと言えます。
SMA(治験事務局担当者)は治験事務局に所属します。治験事務局とは、治験を実施する医療機関において、治験全般の窓口となる部署です。治験事務局は医療機関長の責務を代行し、医療機関によっては治験管理センターや治験管理室とも呼ばれます。
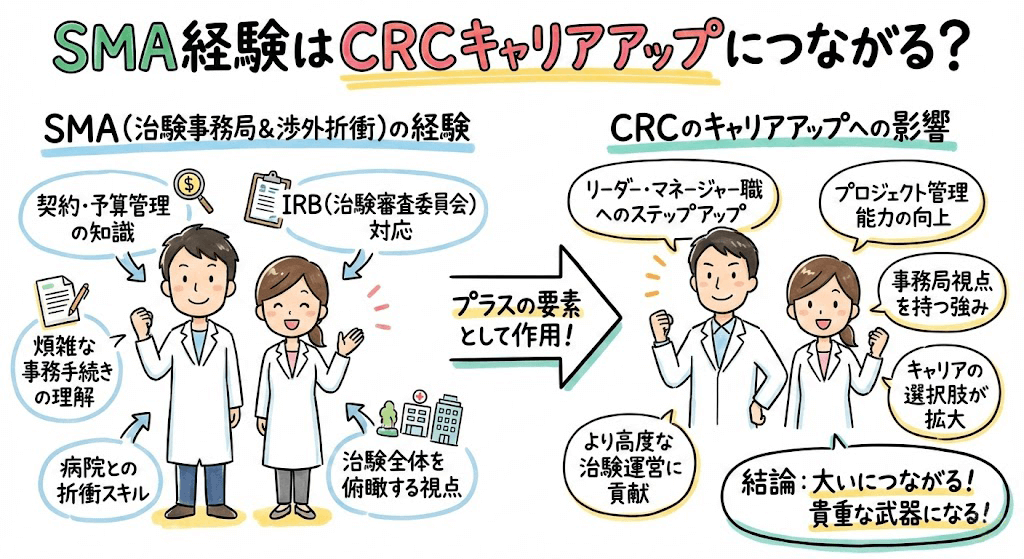
CRCばんくの調査によると、CRC(治験コーディネーター)は女性が多いのに対して、SMA(治験事務局担当者)は男女比が半々、もしくは若干男性の方が多いです。これは、SMA(治験事務局担当者)が製薬会社や医療機関に対する営業的な役割を兼ねることもあるため、女性が避ける傾向があるからだと考えられます。実際、SMA(治験事務局担当者)の求人情報には、医療業界での営業経験を求めるとの記載があることが多いです。
 治験開始前の事前準備
治験開始前の事前準備

医療機関の選定、調査のサポート

SMA(治験事務局担当者)は、CRA(臨床開発モニター)が医療機関の選定や調査をスムーズに行えるように、医療機関が治験を実施できる条件を確認したり、アポイントの日時を調整したり、必要な情報(治験費用、補償と賠償、SDV受入状況など)を提供します。

治験実施の決定、プロトコールの合意

治験責任医師とCRA(臨床開発モニター)は、プロトコール(治験実施計画書)に合意して治験実施を決定します。SMA(治験事務局担当者)は、治験責任医師や治験分担医師の履歴書の作成を補助したり、治験協力者リストの作成を支援します。
IRB(治験審査委員会)の開催・運営

SMA(治験事務局担当者)は、IRBを開催するために必要な審査申請に関する書類の作成を支援します。また、IRBが円滑に開催されるように、審議資料を開催日までにIRB参加者に配布したり、会場設営や司会進行の補助をしたりします。さらに、議事録や必須文書の作成とファイリングなども行います。
治験実施契約書の作成・締結

CRA(臨床開発モニター)が治験契約を円滑に進めるために、SMA(治験事務局担当者)は医療機関のSOP(標準業務手順書)の作成や改訂の助言を行い、治験実施契約書の作成と締結を支援します。
 契約書の主な内容
契約書の主な内容
- GCPの遵守について
- 副作用が発生した際の通知方法
- 治験の継続や中止の基準
- 治験薬の管理方法
- 機密保持について
- モニタリングへの協力内容
- 症例報告書の提出方法
- 費用と賠償金額

東京オフィスや大阪オフィスに所属するSMAは、製薬会社から臨床試験を受注するために、様々な手段で情報収集を行い、担当者と面会して治験が可能な施設を提案したり、見積書を提出したりします。地方オフィスのSMAは、提携先の医療施設を定期的に訪問し、どのような領域の治験に対応可能か情報を収集しておきます。
スタートアップミーティング・勉強会の調整

スタートアップミーティング・勉強会では、治験依頼者との日程調整や出欠確認などを行います。
 勉強会の内容
勉強会の内容
- 治験の概要
- 検査項目
- 治験のスケジュール
- 禁止事項など

 治験運営中の業務
治験運営中の業務

問い合わせ窓口業務

CRA(臨床開発モニター)からの質問や要望に対応し、治験が円滑に進むようにサポートします。

しかし、時間的な制約から、担当施設へは月に1~2回程度しか訪問できない場合も多いです。そのため、「もっと頻繁に訪問したい」という希望を持つSMAもいます。
必須文書の作成・ファイリング・保管

GCPに定められた必須文書を作成し、適切に保管します。
《 必須文書の一例 》
- 記名捺印または署名済みの同意文書
- 被験者のスクリーニング名簿
- 被験者登録名簿
- 医療機関での治験薬の保管・管理記録
- 検査の基準値およびその範囲
- 治験薬概要書の改訂版
- 体液または組織標本の保存記録
- 重篤な有害事象の報告書
- 安全に悪影響を及ぼす情報
- 治験薬割付けコードの開封記録
- 治験実施計画書からの緊急の逸脱または変更に関する文書
- IRBの承認文書
- 記名捺印または署名済みCRF
- 原資料
安全性情報の変更と通知

治験薬の安全性情報に変更があった場合、その内容を関係者に伝えるための文書を作成します。
《 安全性情報の種類 》
- 治験中に発生した重篤な有害事象情報
- 海外での症例情報
- 措置報告(海外・国内)
「医薬品の治験に係る実施報告書」の作成支援

地方厚生局長に提出する報告書の作成を支援します。
《 報告書の内容 》
- 治験依頼者名
- 治験薬の名称および効能・効果
- 対象患者数
- 治験実施期間
モニタリング対応

CRA(臨床開発モニター)は月に数回、症例報告書(CRF)の記入内容を確認するために来院します。SMA(治験事務局担当者)は、モニタリングが円滑に進むように、日時や場所の調整、必要書類の準備などを行います。

被験者登録の促進

医療機関だけでは被験者の目標人数に達しない場合、SMA(治験事務局担当者)は被験者登録を促進するための活動を行います。IRBの承認を得た後、病院内にポスターやチラシを掲示するほか、新聞やインターネットで広告を出したり、ボランティア登録サイトを利用したりします。
 被験者登録の促進の具体例
被験者登録の促進の具体例
- 登録基準に該当する被験者が少ない場合
SMA(治験事務局担当者)は治験担当医師にさらなる協力をお願いしたり、カルテから登録基準に該当する患者を探したり、ボランティアや広告を活用したりして、被験者の登録数を増やす努力をします。 - 登録基準に該当する被験者はいるが、治験参加の同意を得られない場合
SMA(治験事務局担当者)は治験への参加を促すための資料を作成したり、治験参加に関する説明や同意書を改善したりして、治験参加率を上げる工夫をします。
治験費用の請求管理

医療機関が治験契約に基づいて正確な請求書を発行できるように、SMA(治験事務局担当者)は請求金額や請求時期を管理します。
《 主な治験費用の項目 》
- 謝金
- 旅費
- 臨床試験研究経費
- 治験薬管理経費
- 備品費
- 人件費
- 委託料
- 被験者負担の軽減費用
- 事務費
- 管理費
保険外併用療養費の院内処理の調整

各医療機関における保険外併用療養費の請求方法や手順について、適切なアドバイスを行います。
保険外併用療養費制度とは?
本来は認められていない「保険診療」と「保険外診療」の併用(いわゆる混合診療)について、一定の条件下で例外的に認められる制度です。患者が保険適用外の医療(先進医療や選定療養など)を受けた場合でも、それに付随して行われる通常の診療や検査、投薬などについては、健康保険による給付が受けられます。これにより、全額自己負担を避けつつ、最新の医療技術などを取り入れた治療を受けることが可能になります。
監査対応

厚生労働省から委託を受けた医薬品医療機器総合機構の担当者が、治験がGCPに準じて正しく行われているかどうかを調査するために、特定の施設を訪問します。SMA(治験事務局担当者)は、監査が円滑に進むようにサポートします。

 治験終了に伴う業務
治験終了に伴う業務

治験薬や治験用資材の返却準備

治験薬や資材を返却する際には、残量の確認や梱包などの作業が必要です。これらの作業をスムーズに行うために、事前に依頼者から返却方法や期限などを確認しておきます。
治験実施状況報告書、治験終了報告書などの各種資料の作成支援
治験責任医師から治験終了報告書を受け取った後、治験審査事務局(IRB)と治験依頼者に送付するための準備や手続きをサポートします。また、治験を継続して行う場合に必要な治験実施状況報告書などの資料も作成します。
適合性調査への対応

製造販売承認申請を行った際に実施される、治験で得られたデータに関する適合性調査に備えて、必要な資料や情報を整理します。
《 適合性調査のチェック項目 》
- 治験依頼者の組織・体制
- 治験の準備に関する基準
- 治験の管理に関する基準
- 書面調査対象医療機関における治験実施状況

その他

治験審査委員会への継続審議依頼業務支援や、治験契約内容変更依頼の受付および処理などを行います。
医薬品医療機器総合機構からの書面調査と実地調査の対応が完了すれば、全ての治験が終了したことになります。


 よくある質問とみんなの回答
よくある質問とみんなの回答
- Q
- sma(治験事務局担当者)って何ですか?
- A
-
SMOでSMAをしています。
SMAの業務は治験を行う上で必要な事務を行う人です。ですから、治験の専門用語や取り決めと事務スキルさえあれば業務を行うことが可能です。治験コーディネーター(CRC)やモニターと比較して、高度なスキルは必要ありません。そのため、SMAの給与は他の事務員と同じぐらいで、低いことが多いようです。
実際に病院で治験事務局をしている人は医療資格保持者ではなく、ただの事務員だったりすることもあります。また、治験の責任者が事務局業務を兼任している場合も多いです。
ただし、多くのSMOではSMAは医療機関への営業も兼ねている場合が多いです。この場合、SMAには営業的な折衝スキルも求められるため、営業経験者がSMAを行っている場合が多いです。また、一部のSMOではクリニックなどの小さな治験の時は治験コーディネーター(CRC)がSMA業務も兼任しているところがあるようです。
しばしば、MRや看護師・臨床検査技師などがSMAを目指すという声を聞きますが、実際MR出身のSMAはほとんどいません。なぜなら、MRは年収が高く、SMAへ転職すると割が合わないからです。私の周りのSMAはMS(医療品卸の営業)もしくは医療機器営業出身者がほとんどです。また、営業経験がない看護師や臨床検査技師出身者でSMAになっている人は周りには一人もいません。
ご参考ください。






 年収査定はこちら
年収査定はこちら
 合格予想はこちら
合格予想はこちら
 掲示板で質問をする
掲示板で質問をする








 CRC
CRC

 CRCの
CRCの
 CRCの
CRCの
 CRCの
CRCの
 CRCの
CRCの
 CRCに
CRCに
 CRCの
CRCの
 SMO
SMO
 SMO
SMO
 応募先の
応募先の
 治験
治験
 院内CRCと
院内CRCと



 2026年4月からの転職
2026年4月からの転職 CRC未経験特集
CRC未経験特集 CRC経験者特集
CRC経験者特集 看護師特集
看護師特集 臨床検査技師特集
臨床検査技師特集 保健師特集
保健師特集 薬剤師特集
薬剤師特集 管理栄養士特集
管理栄養士特集 臨床工学技士特集
臨床工学技士特集 理学療法士特集
理学療法士特集 作業療法士特集
作業療法士特集 臨床心理士特集
臨床心理士特集 MR特集
MR特集 CRA経験者特集
CRA経験者特集


 求人検索
求人検索  ログイン
ログイン 会員さま専用
会員さま専用 CRCの仕事
CRCの仕事  治験業界の研究
治験業界の研究 経験・資格別の注意点
経験・資格別の注意点 応募書類の作成
応募書類の作成 面接・適性検査の対策
面接・適性検査の対策 みんなのクチコミ
みんなのクチコミ みんなの質問と回答
みんなの質問と回答 転職成功事例
転職成功事例 マンガで分かるCRC
マンガで分かるCRC CRCばんくチャンネル
CRCばんくチャンネル 便利な機能
便利な機能 相談/年収査定/合格予想
相談/年収査定/合格予想 2026年から働くには?
2026年から働くには? 退職手続き
退職手続き 開催中のキャンペーン
開催中のキャンペーン 《CRCばんく》とは
《CRCばんく》とは