
 治験用語集
治験用語集

面接でよく聞かれる用語

面接で聞かれる可能性が高い順に★印をつけています。5つ星(★★★★★)と4つ星(★★★★)は面接で聞かれる可能性が高い重要語ですので、最低限これだけは覚えておきましょう。
面接で最もよく聞かれる 5つ星(★★★★★)
面接でよく聞かれる 4つ星(★★★★)
面接でよく聞かれる 3つ星(★★★)
面接でたまに聞かれる 3つ星(★★★)
あ行

- アブストラクター

- 治験や臨床研究において、患者さんのカルテなどの原資料から、、データベースの作成に必要な情報を登録する専門職のことです。医学的知識や治験や臨床研究のルールに関する理解が求められます。、CRC(治験コーディネーター)が兼任することが多いです。
- アローワンス(アロワンス)

- 治験において許容されている測定値や投与間隔などの誤差の範囲のことです。例えば、「治験薬は28日ごとに投与する」という規定があった場合、厳密に28日目でなくても、前後3日間(25〜31日目)であれば許容するといった幅を設けることがあります。これが「アローワンス」です。
治験ではプロトコルの遵守が重要ですが、現実的な運用を考慮してアローワンスを設定することで、軽微な誤差による逸脱を減らし、より質の高いデータ収集を目指しています。
- アローワンス逸脱

- あらかじめ設定された許容範囲(アローワンス)を超えてしまった場合のことを指します。例えば、上記の例で言えば、25日未満または31日超で治験薬を投与した場合は「アローワンス逸脱」となります。
アローワンス逸脱は、治験実施計画書からの逸脱として記録されます。逸重大な逸脱の場合、データの信頼性に影響したり、治験が中止になったりする場合があります。
- アルコア+(ALCOA-CCEA)

- 治験データの信頼性を確保するための原則で、以下の項目の頭文字をとったものです。
1)Attributable(帰属性):帰属や責任の所在が明確である。
2) Legible(判読性):判読や理解が可能である。
3) Contemporaneous(同時性):同時である。
4) Original(原本性):原本である。
5) Accurate(正確性):正確である。
6) Complete(完全性):完全である。
7) Consistent(一貫性):矛盾がない。
8) Enduring(耐久性、普遍性):永続的である。
9) Available when needed(必要時の利用可能性):必要なときに利用可能である。
- 安全性情報

- 治験に関連する有害事象や副作用の情報のことです。臨床試験では、臨床検査、バイタルサイン、臨床的有害事象(疾患、兆候、症状)、その他の検査(例:心電図)などによって被験者の医療リスクが評価されます。2020年の薬機法の改正(施行日は2021年4月1日)により、治験副作用報告の対象が開発薬だけでなく、併用薬や対照薬も含まれるようになりました。
- 詳しくはこちら
- 安全性情報担当者(PV)

- 治験に関連する有害事象や副作用の情報を収集し、評価する職種です。副作用に関する知識や英語文献を読解する能力が求められます。
- 詳しくはこちら
- 医師主導型治験(医師主導治験)

- 企業から未承認薬の提供を受け、医師が自ら計画し実施する治験のことです。
- 詳しくはこちら
- 逸脱

- 「選択除外基準を満たさない」「検査を忘れる」など、治験実施計画書などの規制を守らないことです。治験実施計画書に規定された内容と異なる行動を取るか、定められた範囲を超える場合は、「治験実施計画書逸脱」「プロトコール逸脱」と言います。逸脱が発生した際には、逸脱報告書を作成し、再発防止の措置を講じる必要があります。
- 違反

- GCPや治験実施計画書などの規制を守らないことです。規定された内容を守らない場合は、「治験実施計画書違反」や「プロトコル違反」と言います。実際には逸脱とほぼ同様の意味で使用されることが多いです。
- 医薬品の臨床試験の実施基準(GCP:Good Clinical Practice)

- 日米EUの三地域で調和された治験の質を確保するための治験の実施に関する基準のことです。日本では「医薬品の臨床試験の実施の基準に関する省令」(厚生省令第28号)は平成9年(1997年)3月公布、同年4月1日に施行されました。
- 医療機関の長の指示、決定

- 実施医療機関の長は、治験審査委員会(IRB)が承認した治験実施計画書および関連文書を遵守し、当該施設における治験がこの省令、治験実施計画書、治験契約書、及び自ら作成した手順書に従って適正かつ円滑に行われるよう、治験薬管理者の選任を含む必要な措置を講じる必要があります。
- インフォームド・コンセント(IC:Informed Consent)

- 治験を希望する患者が、治験担当医師またはCRC(治験コーディネーター)から治験の内容(目的・方法・メリット・リスク等)を記載した同意説明文書の詳しい説明を受け、十分に理解して納得した上で、自由意思によって参加に同意(文書同意)することです。
- 詳しくはこちら
- インフォームド・アセント(Informed Assent)

- 法的規制を受けない、小児被験者からの同意のことです。インフォームド・コンセントは、各国の法律や規則の規制を受けるため義務として実施していますが、それに対してインフォームド・アセントは、法規制上の義務が無いにも関わらず、自発的に医師及び治験スタッフが患者に対して治療に関する説明及び同意取得を行うことです。
例えば、小児集団への臨床試験においては小児被験者から同意取得を行うことは、法律・規則で義務付けされていませんが、被験者の両親及び法的保護者には十分なインフォームド・コンセントが義務付けされています。しかし、もし適切と考えられる場合(治験への参加を理解できる知的レベルにある被験者など)、小児被験者からも臨床試験に参加するための同意を取得すべきであると考えられています。
- ウォッシュアウト(休薬期間:Wash-out period)

- 治験を開始する前に、それまで投与していた薬(前治療薬)の影響を排除するために設けられる休薬期間のことです。治験へ参加することによって、患者の病状が悪化する原因にもなります。
- 詳しくはこちら
- エマージェンシーキー

- 治験期間中に被験者に何らかのトラブルが発生し、治療上やむを得ず割り付けられた情報を開封する際に用意された被験者と治験薬の割付記録のことです。試験終了までキーコードを保管することで盲検性を維持します。
- エンドポイント(Endpoint)

- 治療行為の効果を評価するための評価項目のことです。薬物動態パラメーター、薬力学的評価指標、有効性及び安全性に関連する医薬品の効果を評価するために選定される反応変数です。エンドポイントは治験の目的に適合するものであり、できるだけ客観的な方法で評価可能な項目が望ましいとされています。
- オーファンドラッグ(Orphan drug)

- 希少疾病用医薬品のことです。日本国内で患者数が5万人未満の希少疾患を対象とし、かつ既存治療法が十分でない、もしくはないという高い医療ニーズがある医薬品であり、医療上の必要性が高いにもかかわらず、患者数の少なさから開発が十分に進まないという問題があります。この問題を解決するため、厚生労働省は他の医薬品よりも優先して承認審査を行うなどの対策を取っています。
- オープン試験(Open Clinical Trial/Open-label Trial)

- 盲検法による臨床試験と対比して、被験者・医師など関係者が割付内容を把握している臨床試験を一般にオープン試験と呼びます。対照群を置く場合と置かない場合の両方があります。一般臨床試験とも呼ばれます。バイアスの影響が入りやすいため、薬効評価では解釈に注意が必要ですが、盲検化が困難な場合や長期安全性の確認などに利用されます。
- オンコロジー(Oncology)

- がんなどの腫瘍を対象とする領域のことです。現在、治験における需要が最も高い領域であり、オンコロジー(がん)領域の治験を担当するためには、他の領域よりも専門性が高い知識や経験、調整能力が求められます。
- 詳しくはこちら
か行
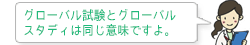
- 開発業務受託機関(CRO:Contract Research Organization)

- 治験依頼者(製薬メーカー等)に代わって開発業務を行う企業のことです。主な業務としては、CRAによるモニタリング業務、DMによるデータマネジメント、統計解析などがあります。
- 詳しくはこちら
- カルテシール

- 症例報告書に記載すべき情報を漏れなくカルテに記入できるように、必須項目が記載されたシール状のシートのことです。治験担当医師は診察時や診療後に記入します。
- 監査

- 治験が治験実施計画書や標準業務手順書、薬機法(旧薬事法)に従って実施され、データが記録・解析され、そして正確に報告されているかを確定するために、治験依頼者が指名した監査担当者が治験に関連する業務や文書を体系的かつ独立に検証することです。
- 観察研究

- 患者の観察結果を分析する研究方法です。
- キーオープン

- エマージェンシーキーを開封する行為のことです。
- 規制当局

- 医薬品・医療機器の開発や治験、市販後安全対策を監督する国家機関の総称のことです。日本は厚生労働省(所管)/医薬品医療機器総合機構 PMDA(審査・安全対策)、海外では米国:FDA、EU:EMAが該当します。
- 組み入れ

- 被験者の適格性を確認した上で、治験に参加させることです。
- 詳しくはこちら
- クロスオーバー比較試験

- 治験における試験デザインの一種であり、交差試験や交互試験とも呼ばれます。同一の被験者に異なる薬剤を時期をずらして服用させ、それぞれの結果を集計し評価することで、薬剤の優劣を判断します。比較的症状が安定している慢性疾患において、傾向変動が少なく、薬剤の効果が速やかに現れ、治療中止後に患者が基準値の状態にすぐに戻り、薬剤の治療効果が可逆的な場合に適した試験方法とされます。
- クリアランス

- 血液中から腎臓やその他の器官によって物質が排除される速度のことです。単位時間あたりに排除される物質量を含む動脈血や血漿の量で表されます。
- 血中濃度

- 投与された薬物の血液中の濃度のことです。一般的には、薬物の作用(効果)の強さは、血中濃度に比例するとされます。また、特定の時点で薬物の血中濃度が半分になるまでの時間を「血中濃度半減期」(T1/2)と呼び、薬物作用の持続性を示す指標とされます。
- ゲノム

- 生物がもつ全ての遺伝情報のことです。
- ゲノム創薬

- 人間を含めた全ての生物の遺伝情報(ゲノム情報)に基づいて、医薬品を開発することです。
- 原資料

- カルテやX線(レントゲン)フィルム等、患者の治療経過を判断する基準となる文書やデータのことです。症例報告書(CRF)を作成する際や、SDV(原資料との照合・検証)を行う時に使用されます。
- 詳しくはこちら
- 公正な立会人

- 治験の実施から独立した立場にあり、治験に関与する者から不当な影響を受けない人物のことです。被験者が同意文書やその他の説明資料を読むことができない場合には、インフォームド・コンセントの過程に立ち会います。
- 厚生労働省

- 厚生労働省は医薬品や医療機器等の最終的な行政措置を実施しています。厚生労働省が管轄するPMDA(独立行政法人医薬品医療機器総合機構)がは実務上の審査等を行っています。
- 抗体医薬品

- 生物が持つ免疫機能の中心的な役割を担う「抗体」の、特定の分子(抗原)にだけ結合する性質を応用した医薬品です。がん細胞や免疫に関わる分子などを標的として、その働きを抑えることで効果を発揮します。
従来の医薬品に比べて副作用が少なく、高い治療効果が期待できるのが特徴ですが、細胞培養ベースの製造と品質管理の複雑さから高価格になりやすいです。
- 詳しくはこちら
- コールセンター

- 治験の案内や受付を担当する専門部署のことです。民間企業に委託する場合と、治験を行う医療機関やSMOに開設される場合があります。
- コモン・テクニカル・ドキュメント

- 医薬品の承認申請のために作成する、日米EU共通の国際共通化資料のことです。CTD(Common Technical Document)とも呼ばれます。審査にかかる負担を減らし、承認審査の迅速化を図るため、記載事項から書式やフォントサイズまで細かく規定されています。電子化されたCTDはeCTDと呼ばれます。
- コンプライアンス(Compliance)

- 医師から処方された薬剤を患者が指示通りに服用することです。服薬遵守とも言われます。また、治験に関わる者が治験を実施する際に法律や規制を遵守することもコンプライアンスと呼ばれます。これら二つの意味が紛らわしいため、服薬遵守を指すコンプライアンスを「服薬コンプライアンス」と表現する場合があります。
さ行

- 再審査

- 新医療用医薬品に関して、承認後一定期間、使用の成績等に関する調査(市販後調査)を行い、その結果を基に医薬品の有効性や安全性を再確認する制度のことです。 承認後、新有効成分含有医薬品は8年、新効能・新用量・新剤形・特定用途医薬品は4~6年、希少疾病用医薬品(オーファンドラッグ)は10年を経過した日から3ヶ月以内に、その新薬の安全性や有効性について厚生労働省の再審査を受けることが義務付けられています。再審査期間が終了すると独占が解除され、後発医薬品の承認申請が可能になります。
- サイトカイン

- 免疫細胞などが分泌するタンパク質の一種で、細胞間の情報伝達を担う物質の総称です。免疫システムの調整、細胞の増殖や分化、炎症反応など、様々な生命現象に関わっています。
医薬品開発においては治療の標的となる一方、治験薬の投与によって過剰に放出されると「サイトカイン放出症候群」といった重篤な副作用を引き起こす場合があります。
- 再評価

- 再審査が終了した後、原則5年(薬効追加などでは6年まで)ごとに品質、有効性、安全性に関して見直しを行うことです。厚生労働大臣が再評価が必要と判断した医薬品について臨床試験等を実施し、再評価報告書を提出する必要があります。
- CRCと臨床試験のあり方を考える会議 (略称:CRCあり方会議)

- 臨床試験の方法について、CRC(治験コーディネーター/臨床研究コーディネーター)らと一緒に考える会議のことです。2001年4月に第1回会議が別府で開催され、参加者は約800名ほどでした。現在では、参加者が3000~4000人規模の会議に発展しています。
- 詳しくはこちら
- 実地調査

- 治験が終了した一部の医療機関に対して、PMDA(独立行政法人医薬品医療機器総合機構)の調査官が訪問し、治験がGCPに沿って適切に行われたかを確認する調査です。
- 重篤な有害事象(SAE:Serious Adverse Event)

- 有害事象や副作用のうち、①死亡に至るもの②生命を脅かすもの③治療のための入院や入院・加療期間の延長が必要なもの④永続的または重大な障害・機能不全を引き起こすもの⑤先天異常を引き起こすもの⑥その他の重大な医学的事象のことです。
治験責任医師は、重篤な有害事象を知り得てから、原則として24時間以内に治験依頼者と実施医療機関の長に対し、重篤な有害事象に関する報告書(SAE報/速報)を提出する必要があります。
- 詳しくはこちら
- 主要評価項目(プライマリーエンドポイント)

- 臨床的または生物学的に意味があり、薬理学的根拠もある客観的な評価が可能な項目です。試験の主要な目的に基づいて選定されます。
- 使用成績調査

- 製造販売後調査の1つで、治験依頼者が医薬品を使用する患者の条件を特定せず、副作用による疾病等の種類別の発現状況や品質、有効性及び安全性に関する情報、その他の適正使用情報を把握するために行われる調査のことです。
- 詳しくはこちら
- 上市(じょうし)

- 承認された新薬が市場販売を開始することです。英語のlaunch(ローンチ)と同義語です。実際に販売が開始された医薬品は上市品と呼ばれます。
- 症例登録

- 治験責任医師や治験分担医師が、候補となる被験者の適格性を判断するために必要な情報を電話やFAX、あるいはWEBを利用して登録センターに報告し、登録センターが適格性を確認した上で、当該臨床試験の被験者として登録する業務のことです。
- 詳しくはこちら
- 症例報告書(CRF:Case Report Form)

- 各被験者の情報を、治験実施計画書(プロトコール)で規定された範囲内で収集し、治験依頼者に報告する際に使用される印刷された、または光学的、電子的に記録された文書のことです。
- 詳しくはこちら
- GCP(医薬品の臨床試験の実施基準:Good Clinical Practice)

- 治験の質を確保するための基準のことです。治験が適切かつ参加者の人権を保護しながら実施されるように、治験依頼者や治験実施医療機関が遵守すべき基準が明記されています。具体的な内容としては、被験者への文書による説明と同意の取得、治験事務局や治験審査委員会(IRB)の設置、製薬企業による治験実施計画書(プロトコール)の作成、製薬企業による治験のモニタリングと監査の実施、各医療機関への治験責任医師の配置などが含まれます。
現行のGCPは1997年3月に公表され、その後2005年4月や2018年6月などに改訂が重ねられています。薬機法(旧薬事法)に基づく省令であり、この基準に違反した企業や医療機関は、治験の中止や新薬の販売停止といった法的な処分を受ける可能性があります。
- 詳しくはこちら
- 関連する用語
- 真のエンドポイント

- 臨臨床試験における治療行為に対して、本来評価したい項目のことです。死亡率、疾患の発症率、QOLの変化、副作用の発現などがあります。
- シングルIRB

- 多施設共同治験において、通常は各医療機関に設置されている治験審査委員会(IRB)の審査を、特定の一つのIRBに集約する仕組みのことです。「中央IRB」や「セントラルIRB」に近いです。審査の重複化を省き、試験の迅速化を図ることで、治験の質の向上と期間短縮が期待されます。
- スクリーニング

- 的確な審査や選別、ふるいわけのことです。健康な人も含む集団から、目的とする疾患の発症者や発症が予想される人を選別する医学的手法のことです。
- 詳しくはこちら
- スタートアップ・ミーティング

- IRB承認後に実施される会議で、治験責任医師、治験分担医師、院内関連部署、CRC、CRAなどの関係者が集まり、治験の実施に関する打ち合わせを行う場のことです。
- 詳しくはこちら
- 製造販売後調査

- 医薬品製造業者が市販後(新薬発売後)に実施する調査です。この調査は、市販前(治験)に得られなかった医薬品の適正使用に関する情報を収集することを目的としています。医薬品製造業者は、GPSP(医薬品の製造販売後の調査及び試験の実施基準)に基づき、この調査を行う義務があります。調査を通じて、日常診療での医薬品の有効性と安全性を確認します。
- 詳しくはこちら
- 製造販売後直後調査

- 製造販売後調査の一つであり、新しい医薬品の販売開始から6ヶ月間行われる調査です。この調査は、診療における適正使用を促進し、法律で規定された事例などの発生を迅速に把握することを目的としています。
- 詳しくはこちら
- 製造販売後臨床試験(第四相試験)

- 新薬が市場に出た後も行われる試験で、有効性と安全性に関する調査を続けながら、標準的な治療法を検討します。
- 詳しくはこちら
- 漸増(ぜんぞう)試験

- 日本では、目的となる疾患の段階に達するまで、徐々に投与量を増加させる「任意漸増法」が一般的に利用されます。
た行

- 第一相試験(フェーズ1)

- 開発中の薬剤を少数の健常者(主に男性)に投与し、主に安全性を検証する試験です。米国ではFDAの症例により女性の被験者が増加していますが、日本では女性の被験者の割合は10〜20%台にとどまっています。
- 詳しくはこちら
- 第二相試験(フェーズ2)

- 第一相試験(フェーズ1)をクリアした薬剤を少数の患者に投与し、安全性、有効性、および用法・用量等を検証する試験です。
- 詳しくはこちら
- 第三相試験(フェーズ3)

- 第二相試験(フェーズ2)をクリアした薬剤を多数の患者に投与し、安全性、有効性、および用法・用量等を検証し、既存の薬剤との比較を行う試験です。
- 詳しくはこちら
- 第四相試験(フェーズ4)

- 厚生労働省によって医薬品として承認・市販された後に、引き続き安全性や有効性の確認する試験です。
- 詳しくはこちら
- 代用エンドポイント

- 医薬品のその他の効果を評価するための項目のことです。主要評価項目に関連していることもあれば、関連していないこともあります。
- 多施設共同IRB

- 単独ではなく、複数の医療機関が共同でIRBを開設・運営することです。多くの多施設共同IRBは、SMOや医師会、地域基幹病院によって開設・運営されています。
- 多施設共同治験

- 単一の治験実施計画書に従って、複数の医療機関で複数の治験責任医師によって実施される治験のことです。
- 脱落(Drop-out)

- 臨床試験(治験を含む)を開始した後、参加者が同意の撤回や来院しないなどの理由で計画通りに臨床試験を続行できなくなった場合やその参加者のことです。被験者自身に続行不能の理由が存在し、副作用や完治といった明確な医学的理由による「中止」とは異なるため、「脱落」と呼んで区別します。
- ダブルダミー法(Double-Dummy)

- 治験薬と対照薬の両方にプラセボを組み合わせて行う方法のことです。例えば、AとBという2種類の薬剤を比較する場合、Aについて実際の製剤と共にそれと区別不可能なプラセボAを用意し、またBについても実際の製剤と共にそれと区別不可能なプラセボBを用意します。
- 単盲検試験(SBT:Single Blind Test)

- 被験者にだけ薬の内容を知らせないで行う試験のことです。
- 治験

- 健康な人や患者を対象に薬の安全性や有効性の確認を行うことを「臨床試験」と言います。その中で、厚生労働省から新薬としての承認を得ることを目的とした臨床試験を「治験」と言います。
- 詳しくはこちら
- 治験依頼者(メーカー、製薬会社)

- 治験の企画、運営管理、資金調達などに責任を負う個人、企業、組織あるいは団体のことです。
- 詳しくはこちら
- 治験施設支援機関(SMO:Site Management Organization)

- 治験を行う施設(病院やクリニック等)を支援する企業のことです。主な業務には、治験業務の支援、IRBの設立と運営、CRCの教育と派遣などがあります。
- 詳しくはこちら
- 治験チーム

- 治験責任医師、治験分担医師、治験協力者から構成される、治験業務を担うメンバーの総称です。治験業務は通常業務と比べて、各メンバー間での連絡や連携が必要とされます。そのため、円滑な治験を促進するために、チーム体制が採用されることが多いです。この名称は正式なものではなく、治験関係者間で用いられる俗称です。
- 詳しくはこちら
- 治験実施計画書からの逸脱等

- 治験実施計画書からの逸脱や変更は、できるだけ避けるべきです。もし逸脱や変更が生じた場合には、そのすべての行為を記録し、治験依頼者、医療機関の長、そして治験審査委員会に提出し、承認を得る必要があります。ただし、被験者の緊急の危険を回避するためや、やむを得ない理由がある場合は、この限りではありません。
- 治験実施計画書(プロトコール)

- 治験の目的、デザイン、方法、統計学的な考察、および組織に関する詳細を記述した文書です。治験実施者(病院やクリニック等)および治験依頼者(製薬メーカー等)が遵守しなければならない、その治験に関するすべての要件が明記されています。
- 詳しくはこちら
- 治験審査委員会(IRB:Institutional Review Board)

- 医学、歯学、薬学の専門家およびそれ以外の者から構成される、医療機関の長や治験責任医師、治験依頼者から独立した委員会のことです。主な責務は、治験実施計画書や治験への同意書等を審査することです。さらに、継続審査を通じて、被験者の人権、安全、福祉の保護を確保します。
- 詳しくはこちら
- 治験審査委員会との関係

- 医療機関での治験の実施に際しては、治験審査委員会に意見を求める必要があります。
- 治験協力者

- 治験責任医師や治験分担医師の指導のもと、専門的な立場から治験の業務に協力する治験コーディネーター、薬剤師、看護師、その他の医療関係者のことです。
- 詳しくはこちら
- 治験コーディネーター(CRC:Clinical Research Coordinator)

- 治験実施施設(病院やクリニック等)において、治験担当医師の指示のもと、治験が円滑に進行するよう各種業務の調整を行う職種のことです。治験に参加する被験者に対して治験の説明を行い、治験参加の同意を取得するインフォームドコンセントの支援が重要な業務の一つとなります。治験コーディネーターとして働くための専門資格は必要ありませんが、看護師や薬剤師、臨床検査技師などの医療従事者が求められることが多いです。
- 詳しくはこちら
- 治験事務局

- 治験実施施設(病院やクリニック等)で行われる治験に関連する事務的な作業全般を担当する部門のことです。治験依頼者(製薬メーカー等)との契約や、必要な書類の作成、各種書類やデータの管理などを主に行います。
- 詳しくはこちら
- 治験事務局担当者(SMA)

- 治験担当医師やCRC、CRAが治験を円滑に進行できるよう支援し、治験に必要な書類の作成や管理、各種委員会などの治験に関連する事務的な作業全般を担当する職種のことです。SMOの場合、製薬企業や医療機関に対する営業的な役割を兼ねることもあります。
- 詳しくはこちら
- 治験実施施設

- 治験業務が実際に行われる場所のことです。
- 詳しくはこちら
- 治験調整委員会

- 多施設共同治験を実施するために、治験依頼者が設置する治験調整医師から構成される委員会のことです。
- 治験調整医師

- 多施設共同治験を実施するために、治験依頼者が選定する各医療機関の治験責任医師を調整する責任を担う医師や歯科医師のことです。
- 治験責任医師(PI)

- 治験実施施設(病院・クリニック等)において、治験の実施に関する責任を有し、治験業務を統括する医師のことです。治験実施施設において、治験が複数の者から構成されるチームにより実施される場合には、治験責任医師はそのチームの責任者となります。治験実施計画書(プロトコール)や同意説明文書の作成や、治験分担医師や治験協力者の任命を行います。
- 詳しくはこちら
- 治験分担医師(SI)

- 治験を実施するチームに参加する個々の医師または歯科医のことです。治験責任医師の指導・監督のもと、治験に関わる重要な業務や決定を行います。
- 治験の総括報告書

- 治験終了後に、治験の目的や方法、成績等をまとめた報告書のことです。
- 治験の中間報告書

- 治験進行中に行われる解析に基づく中間的な治験成績とその評価に関する報告書のことです。
- 治験の継続、中止・中断および終了等

- 治験の継続審査の決定や、治験依頼者からの治験の中止や中断、薬の開発中止の通知があった場合には、治験依頼者、治験責任医師、治験審査委員会など、所定の部門に報告し説明する必要があります。
- 治験の中止または中断

- 治験が中止または中断された場合には、被験者に通知し、適切な治療やフォローアップを行う必要があります。
- 治験薬管理者(IP ADMIN)

- 治験薬の性質や治験実施計画書を理解し、治験薬の保管や管理を担当する薬剤師、医師、歯科医師のことです。通常は薬剤師が担当します。医療機関の長によって指名され、被験者の治験薬使用状況を正確に記録します。治験薬の受領から返却・回収までを管理し、治験依頼者からの要請があった場合には、モニタリングに応じる必要があります。
- 治験薬概要書

- 治験を実施する際に必要となる治験薬に関する非臨床試験と臨床試験の結果をまとめた資料のことです。
- 詳しくはこちら
- 中止

- 副作用や併発症などの医学的な事象が現れたため、治験の対象者から除外することです。
- 長期投与試験

- 第二相試験から第三相試験にかけて、長期間にわたって実施される臨床試験のことです。第二相の二重盲検試験が終了した患者を対象に、長期投与した際の有効性や安全性、副作用の種類や体内蓄積性を確認する目的で行われます。なお、長期試験ではプラセボは使用されません。
- 直接閲覧(SDV:Source Data Verification)

- 治験で提供されたデータの正確性を確認するために、モニターや治験審査委員会の委員、厚生労働省の担当者が病院で保管されているカルテなどの治験関連記録類(原資料)を閲覧することです。
- 詳しくはこちら
- データマネジメント(DM:Data Management)

- 症例報告書(CRF)のデータを統計解析する準備を行うこと、またはその職種のことです。データに問題が見つかった場合は、臨床開発モニター(CRA)に再調査を依頼し、症例データを修正します。ほとんどの業務はデスクワークです。
- 詳しくはこちら
- 同意説明文書

- インフォームド・コンセントの過程で使用される、治験の目的や内容等を詳述した文書一式のことです。
- 詳しくはこちら
- 統計解析

- 生物統計学の手法を用いて治験結果を分析し、治験薬の効果を統計学的に証明すること、またはその職種のことです。データマネジメントにより電子化され、整合化された症例データを基に、統計解析の手法を用いて解析を行います。
- 特定療養費

- 日本の公的医療保険の被保険者が保険の適用範囲外の療養を受ける際に、一定のルールの下で保険外診療との併用が認められる制度のことです。新しい医療技術の出現や患者のニーズの多様化などに対応し、高度先進医療や特別サービスなどについて保険給付との調整を行う目的で創設されました。
- 特別調査

- 製造販売後調査の一つで、治験依頼者が特定の条件を満たす患者群(小児、高齢者、妊娠・出産期の女性、医薬品を長期間使用する患者等、治験で通常は対象とされない患者)を対象として行う調査のことです。特定の患者群における医薬品の有効性や安全性に関する情報、その他の適正使用情報の収集や確認を目的として実施されます。
- 独立データモニタリング委員会

- 治験の進行や安全性データ、および重要な有効性エンドポイントを適切な間隔で評価し、治験依頼者に対して治験の継続、変更、中止を提言する役割を果たす委員会のことです。治験依頼者、治験責任医師、および治験調整医師から独立して設置されます。
- ドラッグ・ラグ、ドラッグ・ロス

- 海外で使用されている治療薬が日本で承認され、使用できるようになるまでの時間差のことです。また、海外で既に使用されている治療薬が日本では開発されず、使用できない状況を「ドラッグ・ロス」と言います。
- 詳しくはこちら
な行

- 二重盲検試験(DBT:Double Blind Test)

- プラセボ反応を排除するために被験者(患者)、試験に関わる医療従事者(医師、CRC、看護師、薬剤師など)、試験データの評価者や解析者(CRA、PVなど)に、どの薬物を用いているかを知らせないで行う試験のことです。
患者の反応性によって生じる偏りや、被験者選択・補助療法・観測評価などによって生じる医師側の偏りを排除することができます。二重盲検比較試験ともいいます。
は行

- バスケット試験

- 特定の遺伝子変異を持つがん患者を、がんの種類に関わらずひとつの試験(バスケット)にまとめて、薬剤の治療効果を評価する臨床試験のことです。
- バリデーション

- 医薬品の製造や品質管理において、必要な手順や工程が適切であることを文書化することです。
- ピカ新・ゾロ新

- ピカ新とは、画期的新薬のことです。新医薬品の中でも特に革新性と有用性が高く、従来の治療法を大きく変える可能性のある新薬や、これまでになかった独創的な新医薬品の俗称です。ゾロ新とは、既存の医薬品の有効成分の化学構造を少し変えただけの改良型新医薬品のことです。 さらにそれを少し変化させた薬をクズ新と呼びます。クズ新は、開発する時間と労力に見合わないとされるため、こう呼ばれます。
- 被験者

- 治験に参加する人のことです。治験の内容に関わらず、治験の説明を受け、治験に参加することに同意した時点で被験者となります。患者、参加者、ボランティアなどとも呼ばれます。
- 詳しくはこちら
- 被験者識別コード

- 被験者の身元情報を保護するため、治験責任医師が各被験者に割り付けた固有の識別符号のことです。治験責任医師が有害事象やその他の治験関連データを報告する際に、被験者の氏名や身元が特定できる番号や住所などの代わりにこの識別コードを使用します。
- 被験者の福祉

- 治験に参加する被験者の肉体的および精神的な健全性を保護することです。
- 必須文書

- 治験の実施状況や得られたデータの質を評価するための文書のことです。
- 詳しくはこちら
- 秘密の保全

- 治験依頼者が保有する情報や被験者の身元に関する情報を、正式に認められた者以外には開示しないことです。
- 標準業務手順書(SOP:Standard Operating Procedures)

- 治験業務を誰が実施しても適切に行えるよう、基本的な業務手順をまとめたマニュアルのことです。
- 詳しくはこちら
- 非臨床試験

- 医薬品の有効性や安全性を確認するため、人を対象としない動物実験などの試験のことです。
- 詳しくはこちら
- 品質管理(QC:Quality Control)

- 治験がGCPを遵守して実施されていることを保証するための活動をQAと言います。その中で治験の質を検証するために行われる品質管理活動をQCと言います。治験がGCPに基づいて業務が適切に行われているかを確認する必要があるため、GCPの十分な理解が必要です。
- 品質保証(QA:Quality Assurance)

- 治験がGCPを遵守して実施されていることを保証するための活動のことです。治験がGCPに基づいて業務が適切に行われているかを確認する必要があるため、GCPの十分な理解が必要です。※QC活動はQAに含まれています。
- 副作用(ADR:Adverse Drug Reaction)

- 治験薬の投与によって発生する有害かつ意図しない反応のことです。治験薬と有害事象との間に少なくとも合理的な因果関係の可能性があり、その関係を否定できない反応を指します。
- 副次的評価項目(セカンダリーエンドポイント)

- 医薬品の他の効果を評価するための項目のことです。主要評価項目に関連していることもあれば、関連していないこともあります。
- 負担軽減費

- 治験に参加することで、被験者は交通費を支払うことや仕事を休むことが求められる場合があります。このような経済的負担を軽減するために被験者に支払われる金額のことです。
- 詳しくはこちら
- 不適合

- 特定臨床研究における、規則、研究計画書、手順書などの不遵守(プロトコル逸脱、プロトコル違反)、研究データの改ざんや捏造のことです。また、臨床研究の対象者の人権や安全性、研究の進捗や結果の信頼性に影響を及ぼすものを重大な不適合と言います。重大な不適合が発生した場合には、速やかに臨床研究審査委員会や実施医療機関の管理者に報告し、再発防止策を講じることが必要です。
- プラセボ(Placebo)

- 患者に心理的な満足感を提供することを目的として与えられる、活性成分を含まない物質のことです。これが有効に作用した場合に見られる肯定的な反応を「プラセボ反応」、否定的な反応を「ノセボ反応」と言います。
- プラセボ効果(プラセボ反応)

- プラセボを摂取したことによる効果のことです。プラセボには有効成分が含まれていませんが、「薬を摂取した」という認識から治療効果が現れることがあります。
- ブリッジング試験(Bridging Study)

- 外国で得られた臨床データが日本でも適用可能かを調査するために日本で行われる臨床試験のことです。日本での効果や安全性、および用法・用量に関連する臨床データや薬力学データを収集することが目的です。
外国人と日本人の基本的データ(第一相・第二相試験)が類似している場合、外国で行われた臨床試験データを日本人にも適用でき、第三相試験を省略することが可能です。ただし、これを実施するためには、その治験薬に関して日本人と他の民族との間で治験データに大きな違いが見られないことを示す必要があります。この試験をブリッジング試験と言います。日本で最初に行われたブリッジング試験は「バイアグラ」です。
- プレシジョンメディシン(精密な医療)

- プレシジョンメディシンは、個々の患者の遺伝子情報や生活習慣、環境要因を詳細に解析し、それぞれに最適な治療法(分子標的薬や免疫療法など)を選ぶ個別化医療のことです。特にがん治療では、DNAやRNAの塩基配列を解析するための装置や技術を用いて遺伝子変異を迅速に特定し、効率的な治療戦略の策定が可能となっています。
- プレヒアリング

- 治験の実施の是非を決定するIRB(機関倫理委員会)の開催前に、治験依頼者が治験責任医師やCRC(臨床研究コーディネータ)などの関連部署に治験の概要を説明し、実施に向けた問題点や対策を共有・検討するための打ち合わせのことです。
- プロトコール(治験実施計画書)

- 治験の目的、デザイン、方法、統計学的な考察、および組織に関する詳細を記述した文書です。治験実施者(病院やクリニック等)および治験依頼者(製薬メーカー等)が遵守しなければならない、その治験に関するすべての要件が明記されています。
- 詳しくはこちら
- ブロックバスター

- ブロックバスターとは、ピーク時の売り上げが10億ドル以上の医薬品のことです。有名なところではED治療薬のバイアグラ。ブロックバスターは毎年10~15品目誕生しています。
- 分散型臨床試験(DCT、Decentralized Clinical Trial)

- 医療機関で行われることが一般的だった臨床試験を自宅などに分散化させることにより、患者が定期的な来院なしで臨床試験に参加できる仕組みのことです。バーチャル臨床試験(VCT、Virtual Clinical Trial)や遠隔治験とも呼ばれ、新たなデジタル技術の活用を基に進められます。
具体的には、被験者の募集・選定を施設単位ではなく全国の患者から行い、オンラインでの説明や電子署名による同意取得、治験薬の患者宅への直接配送、SNSや専用ツールを通じた確認などが行われます。分散型臨床試験(DCT)の導入にあたっては、「同意説明は対面で行う」「治験薬はメーカーから直接配送できない」といった規制をクリアする必要があり、それが今後の課題となっています。
- 詳しくはこちら
- 並行群間比較試験

- 治験薬を投与する群とその対照となる群を設け、同時並行で一定期間投与する方法のことです。多くは二重盲検試験として行われ、最も一般的な試験手法の一つとされています。
- ヘルシンキ宣言

- ヒトを対象とした医学研究の倫理的原則を示す宣言です。世界医師会が1964年に採択し、それ以降数回の修正が行われています。宣言は、周到な計画と自由意志による同意、患者の利益やプライバシーの保護など、臨床研究やヒト組織を用いた研究における医師が遵守すべき倫理規定を定めます。脆弱な参加者の保護と結果公開の透明性などが追加された「ヘルシンキ宣言2024年改訂版」が最新版となっています。
- 保険外併用療養費

- 保険診療と保険外診療が混在する診療において、基礎的な診療部分に対する保険給付を認める制度のことです。これにより、高度先進医療や治験などの際にも、基本的な診察料や処置、手術、麻酔などが保険給付の対象となります。ただし、「治験薬投与期間の全ての検査・画像診断や治験薬と同等の効能・効果を有する医薬品の費用」は治験依頼者の負担となります。
ま行

- マスキング

- 報告書や資料を依頼者に提供する際に、被験者の個人情報(氏名やカルテ番号等)を隠すことです。
- 無作為化

- 偏り(バイアス)を減少させる目的で、被験者を無作為(ランダム)に処置群または対照群に割り付ける方法のことです。
- 無作為割付

- どのような薬物を患者に割り付けるかを無作為(ランダム)に決定する方法のことです。無作為割付を行うことで、患者を意図的に特定の治療に割り当てるといった偏り(バイアス)を排除します。
- メディカルライター(MW)

- 治験薬の概要書や申請概要書、治験総括報告書、臨床論文等の作成業務を担当する専門家のことです。日本語だけでなく、英語での文章作成スキルも必要とされます。
- モニタリング

- 治験依頼者(製薬メーカー等)から任命されたモニター(通常は治験依頼者の開発担当者や、治験依頼者と契約を結んでいるCRO)が治験の進行状況を確認する業務です。治験が治験実施計画書や標準業務手順書、薬機法(旧薬事法)およびGCPの基準に従って適切に実施、記録、報告されているかを訪問や電話等を通じて確認します。
- 詳しくはこちら
- モニタリング報告書

- 治験依頼者(製薬メーカー等)から指名されたモニターが、治験依頼者のSOP(標準業務手順書)に従い、治験実施施設(病院やクリニック等)を訪問した際に治験依頼者に提出する報告書のことです。
- 詳しくはこちら
や行

- 薬機法(旧薬事法)

- 日本における医薬品、医薬部外品、化粧品、および医療機器に関する規制や行政運用を定めた法律です。この法律は、医薬品等の品質、有効性、および安全性の確保のために必要な規制を行っています。
- 薬物動態試験

- 薬物が生体内でどのように処理されるかを明らかにする試験のことです。投与された薬物の血中濃度が最高値から半分の値になるまでの時間を血中濃度半減期と言います。この期間は薬物効果の持続時間の目安とされます。服薬後の所定の時間に採血を行い、血中濃度を測定することで、どの量や時間間隔で薬物を投与すべきかを判断し、効果が持続し副作用が最小限に抑えられるデータを得ることがこの試験の目的です。
- 薬物動態採血(PK採血)

- 薬物動態試験の際に行う採血のことです。同じ患者から1~2日間の間に、一定の時間間隔を空けて7~8回の採血を行うことも珍しくありません。
- 薬物濃度試験

- 人間や実験動物の血液や尿の薬物濃度を測定し、医薬品の吸収過程を追跡する試験のことです。生体試料中薬物濃度測定試験とも言われます。
- 有害事象(AE:Adverse Event)

- 治験薬の投与を受けた被験者に生じるあらゆる不都合な医学的事象のことです。この事象は、治験薬の投与との明確な因果関係があるものだけでなく、治験薬が投与された際に発生する全ての不都合や意図しない症状や兆候(臨床検査値の異常を含む)、あるいは疾患を指します。そして、治験薬との因果関係の有無は考慮されません。
- 詳しくはこちら
- 要因試験(Factorial Study Design)

- 2つ以上の治療法を組み合わせて行う試験デザインのことです。複数の医薬品が同一の反応変数に作用することを期待する場合や、一方の医薬品が他方の医薬品の副作用を軽減することを期待する場合に有用です。要因試験では、各組み合わせ試験が各成分の組み合わせの有効性を示すだけでなく、単剤使用や併用時の用量に関する情報も提供します。
- 用量設定試験(用量反応試験)

- 第二相臨床試験で行われる一つの臨床試験です。パイロット試験の結果を基に、適切な用量と用法を設定するために実施されます。
用量設定試験(用量反応試験)この試験では、承認申請の効能・効果が期待される適応疾患の患者を対象とし、主に二重盲検法を用いて低量、中量、高量の2~3種類の用量の被験薬で、場合によってはプラセボを対照薬として含めて比較試験を行います。この試験の結果から、被験薬の用法・用量・最適用量範囲が設定され、第三相試験で検証されます。また、この試験では、パイロット試験と同様に、治験薬を反復投与する方法(反復投与法)が用いられます。
- 予測できない副作用(未知の副作用)

- 副作用の中で、治験薬に関する既知の情報とその性質や重症度が一致しないものです。
- ラボキット

- 臨床試験(治験)において、被験者から採取した検体を検査するために必要な検査用具や採血用具などをまとめたキットのことです。具体的には採血キットや採尿キットなどがあります。
- 臨床開発モニター(CRA:Clinical Research Associate)

- 医薬品開発の過程で、治験依頼者(製薬メーカー等)から任命され、モニタリングを行う職種のことです。全国の治験を実施している施設(病院やクリニックなど)を訪問し、治験が計画通り進行しているかを確認し、監査(モニタリング)を行います。
臨床開発モニターとしての公式な資格は特にありませんが、看護師や薬剤師、臨床検査技師、MRなどの有資格者や、理系の大学院卒または大学卒が求められることが多いです。カルテを閲覧することもあり、医学的な知識や経験が求められます。また、頻繁に出張が発生する職種です。
- 詳しくはこちら
- リアルワールドデータ(RWD:Real World Data)

- 臨床現場から収集される匿名化された患者データのことです。具体的には、レセプト(診療報酬明細書)などがあり、医薬品の効果や安全性の評価に利用されます。政府が法的な整備を進めています。このデータから得られるエビデンスはリアルワールドエビデンス(RWE:Real World Evidence)と呼ばれます。
- リモートSDV

- 治験依頼者が、治験に参加した患者の臨床データと医療機関の原資料(カルテ等)をインターネット経由で確認(SDV/Source Data Verification)・モニタリングする仕組みのことです。
- 臨床試験コーディネーター

- 臨床試験のコーディネーションを専門とする職種です。治験コーディネーター(CRC)や臨床研究コーディネーターを含め、臨床試験コーディネーターと呼ぶこともあります。
- 臨床研究

- 人を対象として行われる医学研究全般のことです。臨床研究法では、「医薬品等を人に対して用いることにより、医薬品等の有効性や安全性を明らかにする研究(治験を除く)」と定義されています。
- 詳しくはこちら
- 臨床研究法

- ディオバン事案(ノバルティス社の高血圧治療薬ディオバンに関連した臨床試験でのデータ操作)などの不正を防ぐ目的で、平成30年4月1日から施行されている法律です。この法律は、薬機法(旧薬事法)の対象外である未承認や適応外の医薬品等の臨床研究や、製薬企業からの資金提供を受けた医薬品等の臨床研究を特定臨床研究として規定し、基準遵守義務を定めています。さらに、製薬企業からの資金提供の公表義務や臨床研究の主要な業務手順が定められています。
- 詳しくはこちら
- 臨床研究コーディネーター

- 治験以外の臨床研究や特定臨床研究を専門に行うコーディネーターのことです。治験コーディネーターを含め、臨床研究コーディネーターと呼ぶこともあります。
- ワークシート

- 症例報告書を作成する際に、カルテとは別に使用される記録用紙のことです。プロトコール(治験実施計画書)に記載されているすべての項目をカルテに記録するのは困難な場合が多いため、治験依頼者が独自に作成したワークシートを併用することが一般的です。これは原資料の確保としても役立ちます。カルテとワークシートのデータ間で不整合が生じないように設計されています。
- ローカル治験(ローカルスタディ/国内治験)

- 国内治験とも呼ばれ、日本国内のみで行われる治験のことです。
- 関連する用語
略語(A~Z)

- ADR(副作用:Adverse Drug Reaction)

- 治験薬の投与によって発生する有害かつ意図しない反応のことです。治験薬と有害事象との間に少なくとも合理的な因果関係の可能性があり、その関係を否定できない反応を指します。
- AE(有害事象:Adverse Event)

- 治験薬の投与を受けた被験者に生じるあらゆる不都合な医学的事象のことです。この事象は、治験薬の投与との明確な因果関係があるものだけでなく、治験薬が投与された際に発生する全ての不都合や意図しない症状や兆候(臨床検査値の異常を含む)、あるいは疾患を指します。そして、治験薬との因果関係の有無は考慮されません。
- 詳しくはこちら
- ALCOA+(ALCOA-CCEA)

- 治験データの信頼性を確保するための原則で、以下の項目の頭文字をとったものです。
1)Attributable(帰属性):帰属や責任の所在が明確である。
2) Legible(判読性):判読や理解が可能である。
3) Contemporaneous(同時性):同時である。
4) Original(原本性):原本である。
5) Accurate(正確性):正確である。
6) Complete(完全性):完全である。
7) Consistent(一貫性):矛盾がない。
8) Enduring(耐久性、普遍性):永続的である。
9) Available when needed(必要時の利用可能性):必要なときに利用可能である。
- ARO(アカデミック臨床研究機関:Academic Research Organization)

- 研究機関や医療機関を持つ大学などが、その機能を活用して医薬品開発を含む臨床研究や非臨床研究を支援する組織のことです。薬機法よりも臨床研究法に基づく業務の割合が多いと言われています。CROと混同されやすいですが、AROは組織規模が小さいことが多く、希少疾患の研究に対応しやすいと言われています。予算が限られることが多いため、「チープCRO」とも呼ばれることがあります。
- CIOMS(国際医学団体協議会:Council for International Organizations of Medical Sciences)

- CIOMS(シオムス)とは国際医学団体協議会の略称です。世界保健機構(WHO)と国際連合教育科学文化機関(UNESCO)によって1949年に設立されました。CIOMSは有害事象報告書の書式の標準化を図り、一般に流布させた団体で、その書式は「CIOMS form」と呼ばれています。
臨床試験中に被験者・患者に有害事象が発生した場合、医師はその有害事象を報告しなければなりません。そのために症例報告書(CRF)を作成しますが、その中でも重要な有害事象・重篤な有害事象が認められた場合、CRFとは別に有害事象報告書も作成されます。さまざまな様式がありますが、特に英文の原稿ではこの「CIOMS form」を用いて作成されることが一般的です。
- CRA(臨床開発モニター:Clinical Research Associate)

- 医薬品開発の過程で、治験依頼者(製薬メーカー等)から任命され、モニタリングを行う職種のことです。全国の治験を実施している施設(病院やクリニックなど)を訪問し、治験が計画通り進行しているかを確認し、監査(モニタリング)を行います。
臨床開発モニターとしての公式な資格は特にありませんが、看護師や薬剤師、臨床検査技師、MRなどの有資格者や、理系の大学院卒または大学卒が求められることが多いです。カルテを閲覧することもあり、医学的な知識や経験が求められます。また、頻繁に出張が発生する職種です。
- 詳しくはこちら
- CRC(治験コーディネーター:Clinical Research Coordinator)

- 治験実施施設(病院やクリニック等)において、治験担当医師の指示のもと、治験が円滑に進行するよう各種業務の調整を行う職種のことです。治験に参加する被験者に対して治験の説明を行い、治験参加の同意を取得するインフォームドコンセントの支援が重要な業務の一つとなります。治験コーディネーターとして働くための専門資格は必要ありませんが、看護師や薬剤師、臨床検査技師などの医療従事者が求められることが多いです。
- 詳しくはこちら
- CRF(症例報告書:Case Report Form)

- 各被験者の情報を、治験実施計画書(プロトコール)で規定された範囲内で収集し、治験依頼者に報告する際に使用される印刷された、または光学的、電子的に記録された文書のことです。
- 詳しくはこちら
- CRO(開発業務受託機関:Contract Research Organization)

- 治験依頼者(製薬メーカー等)に代わって開発業務を行う企業のことです。主な業務としては、CRAによるモニタリング業務、DMによるデータマネジメント、統計解析などがあります。
- 詳しくはこちら
- CTMS(治験管理システム:Clinical Trial Management System)

- 治験の全プロセスを一元的に管理するシステムのことです。データが一元化されることで、治験の効率化およびコスト削減が可能になります。
- 詳しくはこちら
- CTD(コモン・テクニカル・ドキュメント:Common Technical Document)

- 医薬品の承認申請のために作成する、日米EU共通の国際共通化資料のことです。審査にかかる負担を減らし、承認審査の迅速化を図るため、記載事項から書式やフォントサイズまで細かく規定されています。電子化されたCTDはeCTDと呼ばれます。
- DBT(二重盲検試験:Double Blind Test)

- プラセボ反応を排除するために患者や医師、CRCに、どの薬物を用いているかを知らせないで行う試験のことです。患者の反応性によって生じる偏りや、被験者選択・補助療法・観測評価などによって生じる医師側の偏りを排除することができます。二重盲検比較試験ともいいます。
- DCT(分散型臨床試験:Decentralized Clinical Trial)

- 医療機関で行われることが一般的だった臨床試験を自宅などに分散化させることにより、患者が定期的な来院なしで臨床試験に参加できる仕組みのことです。バーチャル臨床試験(VCT、Virtual Clinical Trial)や遠隔治験とも呼ばれ、新たなデジタル技術の活用を基に進められます。
具体的には、被験者の募集・選定を施設単位ではなく全国の患者から行い、オンラインでの説明や電子署名による同意取得、治験薬の患者宅への直接配送、SNSや専用ツールを通じた確認などが行われます。分散型臨床試験(DCT)の導入にあたっては、「同意説明は対面で行う」「治験薬はメーカーから直接配送できない」といった規制をクリアする必要があり、それが今後の課題となっています。
- 詳しくはこちら
- DM(データマネジメント:Data Management)

- 症例報告書(CRF)のデータを統計解析する準備を行うこと、またはその職種のことです。データに問題が見つかった場合は、臨床開発モニター(CRA)に再調査を依頼し、症例データを修正します。ほとんどの業務はデスクワークです。
- 詳しくはこちら
- EBP(Emerging Biopharma)

- 海外の小規模な新興バイオ医薬品企業を指します。バイオベンチャーやバイオテック企業とほぼ同義で使われることもあります。多くは製造販売経験がなく大手との提携やM&Aを通じて商業化を図ることが多いです。
- eConsent(電子的同意取得/eコンセント)

- デジタルデバイスやネットワークを利用して治験の説明や同意取得を行うことです。例えば、事前に用意した動画で治験の説明を行い、タブレットでの電子署名により同意を取得する方法があります。これにより、患者は病院へ足を運ばなくても、自宅から治験への参加意向を示すことができます。
- 詳しくはこちら
- eCRF

- 電子化された症例報告書のことです。
- 詳しくはこちら
- eCOA(electronic Clinical Outcome Assessment、電子臨床アウトカム評価)

- ePROを含む臨床試験で収集される疾患の状態や病気の予後等を評価するシステムのことです。
- 詳しくはこちら
- ePD(electronic epatient diaries 電子患者日記)

- 患者が病気や治療の影響、不明な点などを自由に記録し、医療提供者と適切にコミュニケーションをとるための電子日記帳のことです。
- 詳しくはこちら
- ePRO(electronic Patient Reported Outcome、患者報告アウトカム電子システム)

- 紙の調査票ではなく、デジタルデバイス(例:タブレットやスマートフォン)を利用して、患者の状態や状況を医療提供者にリアルタイムで報告できるシステムのことです。
- 詳しくはこちら
- eSourece

- 治験の原資料として用いられる、電子的に記録された情報のことです。
- 詳しくはこちら
- EDC(Electronic Data Capture)

- 治験データ(例:検査値)を収集・管理するための電子化システムのことです。治験担当医師や治験スタッフは、臨床の現場で得られた症例データをパソコンに入力し、インターネットや専用回線で治験依頼者へ報告します。治験依頼者は送信されたデータの欠損や整合性をリアルタイムで確認できます。
- 詳しくはこちら
- FDA(アメリカ食品医薬品局:Food and Drug Administration)

- アメリカ合衆国の公的機関で、日本の厚生労働省に相当する組織のことです。
- FPI(First Patient In)

- 試験全体で最初に登録される患者のことです。一部のSMOでは、表彰の対象としている場合があります。
- GCP(医薬品の臨床試験の実施基準:Good Clinical Practice)

- 治験の質を確保するための基準のことです。治験が適切かつ参加者の人権を保護しながら実施されるように、治験依頼者や治験実施医療機関が遵守すべき基準が明記されています。具体的な内容としては、被験者への文書による説明と同意の取得、治験事務局や治験審査委員会(IRB)の設置、製薬企業による治験実施計画書(プロトコール)の作成、製薬企業による治験のモニタリングと監査の実施、各医療機関への治験責任医師の配置などが含まれます。
現行のGCPは1997年3月に公表され、その後2005年4月や2018年6月などに改訂が重ねられています。薬機法(旧薬事法)に基づく省令であり、この基準に違反した企業や医療機関は、治験の中止や新薬の販売停止といった法的な処分を受ける可能性があります。
- 詳しくはこちら
- 関連する用語
- GLP(非臨床試験の実施の基準:Good Laboratory Practice)

- 非臨床試験での動物を用いた安全性試験の品質を確保するための基準のことです。
- GMP(医薬品の製造管理・品質管理に関する基準:Good Manufacturing Practice)

- 医薬品製造工場における製造管理と品質管理の品質を確保するための基準のことです。
- GPMSP(医薬品の市販後の調査の質を確保するための基準:Good Post-Marketing Surveillance Practice)

- 医薬品の市販後の調査の品質を確保するための基準のことです。
- GPSP(医薬品の製造販売後の調査及び試験の実施に関する基準:Good Post-marketing Study Practice)

- 医薬品の再審査や再評価資料の収集・作成に関する基準のことです。2005年4月にGPMSPが廃止され、新たにこの基準が施行されました。
- GVP(医薬品などの製造販売後の安全管理に関する基準:Good Vigilance Practice)

- 医薬品、医薬部外品、化粧品、医療機器の適正使用情報の収集や検討、市販後の安全確保措置の実施に関する基準のことを指します。この基準も2005年4月にGPMSPが廃止された際に新たに施行されました。
- IC(インフォームド・コンセント:Informed Consent)

- 治験を希望する患者が、治験担当医師またはCRC(治験コーディネーター)から治験の内容(目的・方法・メリット・リスク等)を記載した同意説明文書の詳しい説明を受け、十分に理解して納得した上で、自由意思によって参加に同意(文書同意)することです。
- 詳しくはこちら
- ICH(医薬品規制調和国際会議)

- 医薬品の承認審査の技術要件を調和することを目的とした国際会議のことです。データの国際的な相互受け入れを実現し、臨床試験や動物実験の不必要な繰り返しを防ぎ、優れた医薬品をより速やかに患者へ届けることを目的として、1990年から主に日米欧で開催されています。
- ICH-GCP(The International Conference on Harmonization Guidelines for Good Clinical Practice)

- ICHで策定された、医薬品の臨床試験結果を三大地域(日本、アメリカ、ヨーロッパ)間で相互に受け入れを促進する国際基準のことです。GCPはICH-GCPを基にしているものの、日本独自の規定も含まれており、これがドラッグ・ラグやドラッグ・ロスの一因とされています。日本のGCPは、ICH-GCPと対比して、省令GCPやJ-GCPと呼ばれます。
- 関連する用語
- IEC(倫理委員会:Independent Ethics Committee)

- 医学や科学分野以外の委員で構成される独立した組織のことです。その主な責務は、被験者の人権と安全の保護、インフォームドコンセントの取得及び証拠の記録方法、そして試料の審査・承認・是認を行い、被験者の保護に公的な補償を提供することです。ヨーロッパではIRB(倫理審査委員会)と呼ばれており、機能も同じです。
- IP(治験薬:Investigational Product)

- 治験に用いられる、有効成分を含んだ製剤(承認の有無を問わない)やプラセボのことです。治験薬または対照薬として使用されます。
- IRB(治験審査委員会:Institutional Review Board)

- 医学、歯学、薬学の専門家およびそれ以外の者から構成される、医療機関の長や治験責任医師、治験依頼者から独立した委員会のことです。主な責務は、治験実施計画書や治験への同意書等を審査することです。さらに、継続審査を通じて、被験者の人権、安全、福祉の保護を確保します。
- 詳しくはこちら
- Investigator Meeting(インベスティゲーター・ミーティング)

- 治験依頼者が、治験に参加する治験責任医師や治験分担医師、CRCなどの医療機関スタッフを対象に実施する会議のことです。治験薬の概要、治験実施計画書(プロトコル)の内容、遵守事項などを詳細に説明し、治験を円滑かつ適切に進めることを目的とします。治験開始前に開催されるのが一般的です。
- IRT(Interactive Response Technology)

- 治験における無作為化割付や治験薬供給に関する業務全般を管理するためのITシステムの総称です。
- LPI(Last Patient In)

- 試験全体での最後の患者登録のことです。試験開始から短期間で契約分の症例登録が完了すると、原価が抑制されるため、SMOによっては表彰の対象になることがあります。
- MedDRA(医薬品規制用語集:Medical Dictionary for Regulatory Activities Terminology)

- 医薬品に関連する国際間の情報交換を迅速かつ的確に行うために、ICHによって策定された医薬品規制用語集のことです。
- MedWatch

- 米国食品医薬品局(FDA)の安全性情報および有害事象報告プログラムのことです。1993年に設立され、医療における有害事象に関するデータを収集しています
- MR(医薬情報担当者:Medical Representative)

- 医薬品の適正使用に関し、医療関係者に適切な使用情報を提供し、情報収集を行う職種のことです。
- MW(メディカルライター:Medical Writer)

- 治験薬の概要書や申請概要書、治験総括報告書、臨床論文等の作成業務を担当する専門家のことです。日本語だけでなく、英語での文章作成スキルも必要とされます。
- NCD(一般社団法人National Clinical Database)

- 様々な疾患・治療・手術に関する日本全国の医療情報を収集しているデータベースを運用する団体のことです。学会や学術団体と協力し、収集したデータの管理運用を行っています。集められたデータは、国内の研究に用いられ医療水準の評価及び臨床研究の支援などに役立てられています。
- OTC(一般用医薬品)

- 薬局で処方箋なしで購入できる医薬品のことです。薬剤師などの適切なアドバイスを基に、利用者は自己判断および自己責任で使用します。
- PMDA(独立行政法人医薬品医療機器総合機構)

- 医薬品や医療機器などの承認審査や安全対策業務を行う、厚生労働省が管轄する独立行政法人のことです。
- PMS(Post Marketing Surveillance)

- 厚生労働省によって認可された後、販売及び流通が始まった新薬の有効性や安全性を確認するために行われる調査です。PMSで行われる調査は、GPSP(Good Post-marketing Study Practice:製造販売後調査・試験実施基準)及びGVP(Good Vigilance Practice:製造販売後安全管理基準)を遵守して行います。
PMSとして行われる調査には、主に以下の3つがあります。使用成績調査:新薬の服用者から、特定の条件を設けず、有効性や副作用に関する情報を広く収集する調査。特定使用成績調査:治験で対象外とされたグループ(小児、高齢者、妊産婦、腎機能障害や肝機能障害を有する人、長期使用者)を対象に、特定の条件下で新薬の有効性や副作用を確認する調査。市販直後調査:新薬投与後の患者状態を6ヶ月間追跡する調査。全ての関連医療機関で実施し、2001年の薬事法改正に基づき実施が義務化されています。
- 詳しくはこちら
- PV(ファーマコビジランス:Pharmacovigilance)

- 治験に関連する有害事象や副作用の情報を収集し、評価する職種のことです。副作用の知識や、英文の読解力が求められます。
- 詳しくはこちら
- PRT(プロトコール:Protocol)

- Protocolを略して用いる言葉で、治験実施計画書のことです。
- 関連する用語
- QC(品質管理:Quality Control)

- 治験がGCPを遵守して実施されていることを保証するための活動をQAと言います。その中で治験の質を検証するために行われる品質管理活動をQCと言います。治験がGCPに基づいて業務が適切に行われているかを確認する必要があるため、GCPの十分な理解が必要です。
- QA(品質保証:Quality Assurance)

- 治験がGCPを遵守して実施されていることを保証するための活動のことです。治験がGCPに基づいて業務が適切に行われているかを確認する必要があるため、GCPの十分な理解が必要です。※QC活動はQAに含まれています。
- REDCap

- 米国Vanderbilt大学が開発したデータ集積管理システムのことです。IT専門家でなくとも簡単にWeb上でデータベースの構築と管理ができ、多施設のデータを簡単安全に集積できるシステムで、アカデミック医学研究では世界標準になりつつある臨床研究支援ツールです。
- SAE(重篤な有害事象:Serious Adverse Event)

- 有害事象や副作用のうち、①死亡に至るもの②生命を脅かすもの③治療のための入院や入院・加療期間の延長が必要なもの④永続的または重大な障害・機能不全を引き起こすもの⑤先天異常を引き起こすもの⑥その他の重大な医学的事象のことです。
治験責任医師は、重篤な有害事象を知り得てから、原則として24時間以内に治験依頼者と実施医療機関の長に対し、重篤な有害事象に関する報告書(SAE報/速報)を提出する必要があります。
- 詳しくはこちら
- SAE報(重篤な有害事象に関する報告書)

- 重篤な有害事象報告書のことで、通常は「SAE報」と略称されます。SAE報は、「速報」(SAE発生直後の初報)と、「詳細報・追加報」(詳細が分かった段階での後続報告)の2種類に分けられます。
- SIV(開始訪問:Site Initiation Visit)

- 臨床試験開始前に製薬会社が施設で行う最終確認のことです。SIVでは医師、CRA、CRCなど多くの担当者が集まり、実務の最終確認を行います。
- SBT(単盲検試験:Single Blind Test)

- 被験者にだけ薬の内容を知らせないで行う試験のことです。
- SDV(直接閲覧:Source Data Verification)

- 治験で提供されたデータの正確性を確認するために、モニターや治験審査委員会の委員、厚生労働省の担当者が病院で保管されているカルテなどの治験関連記録類(原資料)を閲覧することです。
- 詳しくはこちら
- SMA(治験事務局担当者:Site Management Associate)

- 治験担当医師やCRC、CRAが治験を円滑に進行できるよう支援し、治験に必要な書類の作成や管理、各種委員会などの治験に関連する事務的な作業全般を担当する職種のことです。SMOの場合、製薬企業や医療機関に対する営業的な役割を兼ねることもあります。
- 詳しくはこちら
- SMO(治験施設支援機関:Site Management Organization/)

- 治験を行う施設(病院やクリニック等)を支援する企業のことです。主な業務には、治験業務の支援、IRBの設立と運営、CRCの教育と派遣などがあります。
- 詳しくはこちら
- SOP(標準業務手順書:Standard Operating Procedures)

- 治験業務を誰が実施しても適切に行えるよう、基本的な業務手順をまとめたマニュアルのことです。
- 詳しくはこちら
- SUM(Start Up Meeting)

- IRB承認後に実施される会議で、治験責任医師、治験分担医師、院内関連部署、CRC、CRAなどの関係者が集まり、治験の実施に関する打ち合わせを行う場のことです。
- 詳しくはこちら
- TMF(Trial Master File)

- ICH-GCPで規定される必須文書(Essential Document)と、治験の実施及びデータ品質に関わる評価を補助する文書を含む、治験関連文書群のことです。
- visit

- プロトコールで規定される被験者の来院のことです。






 年収査定はこちら
年収査定はこちら
 合格予想はこちら
合格予想はこちら
 掲示板で質問をする
掲示板で質問をする








 CRC
CRC

 CRCの
CRCの
 CRCの
CRCの
 CRCの
CRCの
 CRCの
CRCの
 CRCに
CRCに
 CRCの
CRCの
 SMO
SMO
 SMO
SMO
 応募先の
応募先の
 治験
治験
 院内CRCと
院内CRCと



 2026年4月からの転職
2026年4月からの転職 CRC未経験特集
CRC未経験特集 CRC経験者特集
CRC経験者特集 看護師特集
看護師特集 臨床検査技師特集
臨床検査技師特集 保健師特集
保健師特集 薬剤師特集
薬剤師特集 管理栄養士特集
管理栄養士特集 臨床工学技士特集
臨床工学技士特集 理学療法士特集
理学療法士特集 作業療法士特集
作業療法士特集 臨床心理士特集
臨床心理士特集 MR特集
MR特集 CRA経験者特集
CRA経験者特集


 求人検索
求人検索  ログイン
ログイン 会員さま専用
会員さま専用 CRCの仕事
CRCの仕事  治験業界の研究
治験業界の研究 経験・資格別の注意点
経験・資格別の注意点 応募書類の作成
応募書類の作成 面接・適性検査の対策
面接・適性検査の対策 みんなのクチコミ
みんなのクチコミ みんなの質問と回答
みんなの質問と回答 転職成功事例
転職成功事例 マンガで分かるCRC
マンガで分かるCRC CRCばんくチャンネル
CRCばんくチャンネル 便利な機能
便利な機能 相談/年収査定/合格予想
相談/年収査定/合格予想 2026年から働くには?
2026年から働くには? 退職手続き
退職手続き 開催中のキャンペーン
開催中のキャンペーン 《CRCばんく》とは
《CRCばんく》とは